万事娱乐生命科學學院李根喜教授團隊近期在《Nucleic Acids Research》雜誌上發表了題為“Hydrazone chemistry-mediated CRISPR/Cas12a system for bacterial analysis”(Nucleic Acids Research, gkac809, https://doi.org/10.1093/nar/gkac809)的原創性研究論文。

該研究工作通過采用腙化學和巧妙的核酸序列設計,利用互補堿基配對引起的鄰近效應加速整個激活鏈的形成🆙,從而快速有效地激活CRISPR/Cas12a系統🚳,並進而提出了一種簡單而靈敏的銅綠假單胞菌分析方法。
Cas12a是一種來自V-A型CRISPR系統的核酸內切酶,通過識別其靶位點👨🏽🍼,激活內源性核酸酶活性後,可以不加區分地切割單鏈DNA(ssDNA)🔞,已被用於核酸檢測。然而🧑🏿🏫,該系統不適合區分非常相似的單鏈DNA序列;並且💪🏿🦸🏼,相似單鏈DNA序列之間的幹擾可能會發生交叉反應,影響分析的靈敏度和特異性𓀈。由於CRISPR/Cas系統的可編程性依賴於導鏈RNA和核酸的相互作用👨🏻💼,研究團隊設想可以在系統的啟動序列中引入腙化學,從而更靈活地激活CRISPR/Cas12a系統💝,不僅可以提高特異性🐂,而且可以廣泛應用於不同靶標的分析。
為了將腙化學應用於CRISPR/Cas12a系統中,研究團隊巧妙地將激活鏈設計為發夾結構的兩個片段,並分別由酰肼和醛基兩個腙連接基團修飾💅。在堿基互補配對的作用下📱,含有酰肼基團的TS1更容易與修飾醛基基團的TS2鏈通過腙鍵反應形成完整的TS1/TS2鏈。激活的Cas12a/crRNA復合體的反式裂解活性導致ssDNA-FAM的任意切割和熒光恢復(圖1)。腙化學的引入可以提高CRISPR/Cas12a系統的特異性,可以有效區分目標序列中的單堿基錯配🧔🏼。
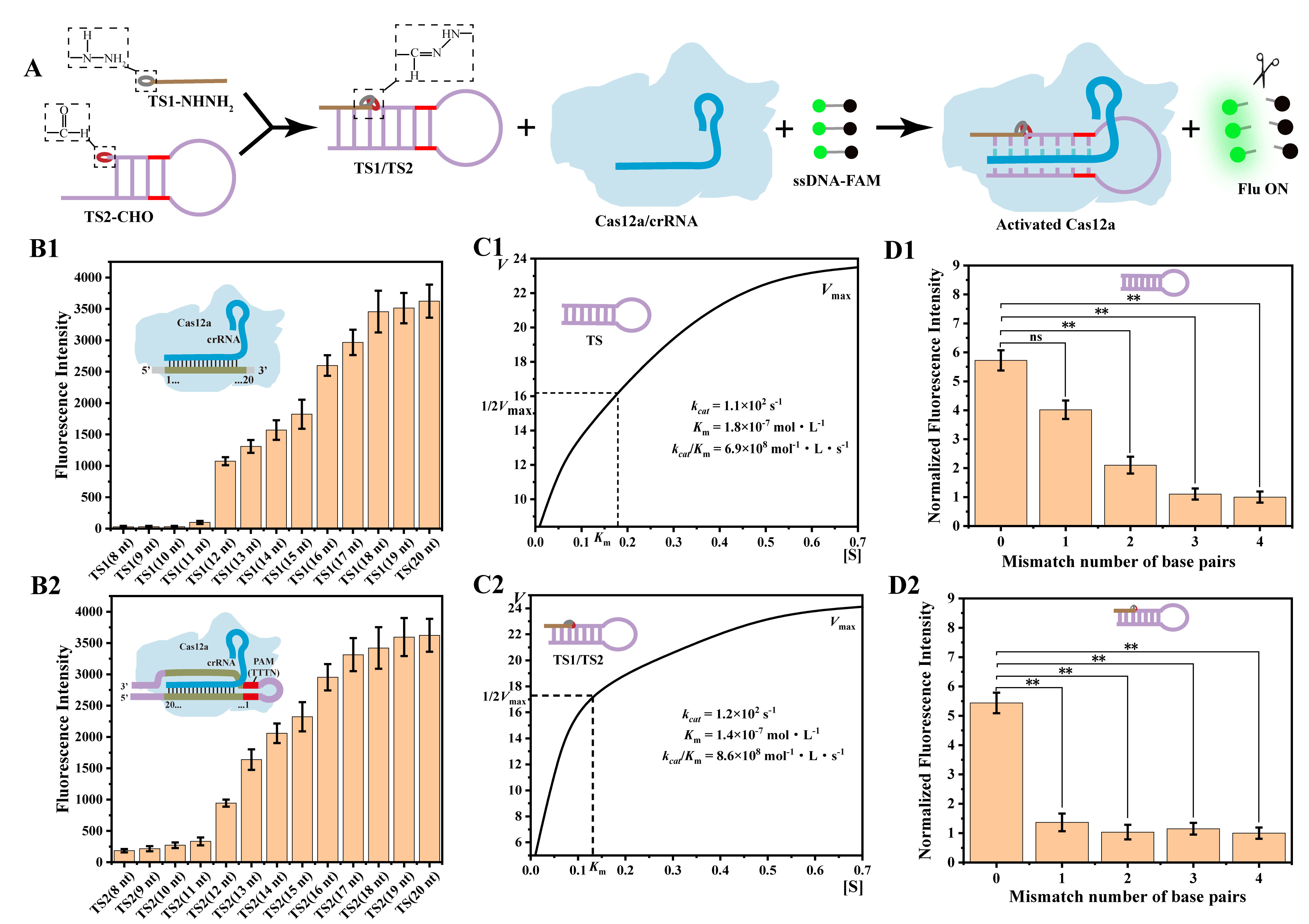
圖1 腙化學介導的CRISPR/Cas12a系統
研究團隊將所構建的腙化學介導CRISPR/Cas12a系統進一步用於細菌分析👉🏿,他們選取了具有物種間高度保守的區域和物種特異性的可變區域16S rRNA基因序列(16S rDNA)作為靶標🦸🏿💚,該序列也通常被用於各種細菌的鑒定。研究團隊精心設計16S rDNA探針互補序列➖,由於16S rDNA與探針的特異性結合🗞,從而釋放Probe/TS1-NHNH2雜交鏈中的TS1-NHNH2,該鏈可以通過堿基互補配對與TS2-CHO雜交🧑🏿🦳,其中TS1-NHNH2修飾的酰肼基與TS2-CHO修飾的醛基之間的腙鍵加速TS1/TS2的形成💌,而形成的TS1/TS2可以激活CRISPR/Cas12a系統,對ssDNA-FAM進行切割,導致熒光的恢復(圖2)。
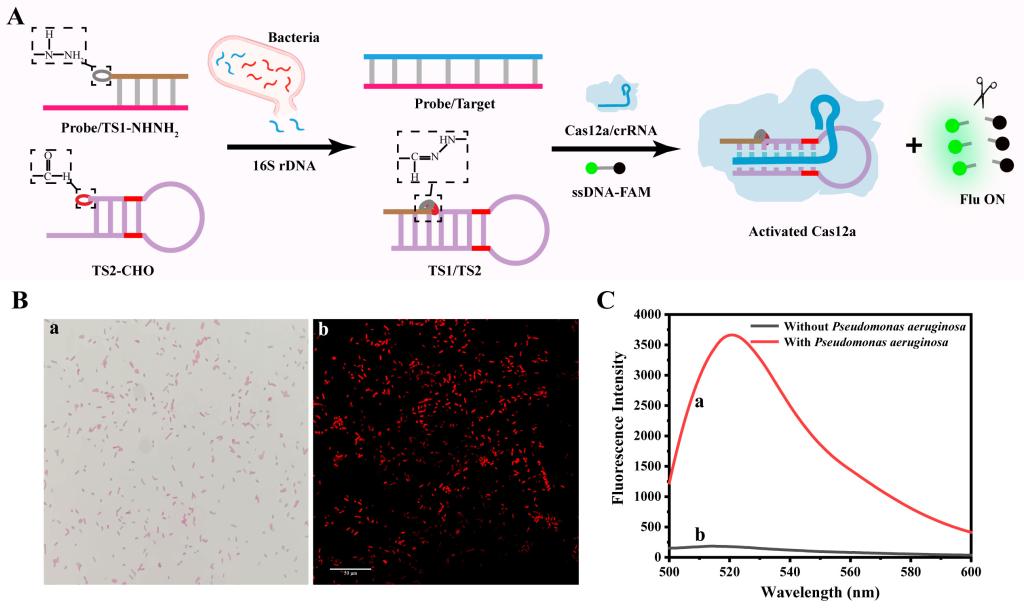
圖2 基於腙化學介導的CRISPR/Cas12a系統的細菌分析機理
綜上所述,研究團隊構建了一個腙化學介導的CRISPR/Cas12a系統,並探索了其識別單堿基錯配的能力。在這一設計中,他們利用堿基互補配對產生的鄰近效應加速了腙鍵的形成。同時👱🏿♂️,由於其模塊化和獨特的結構性質,腙化學可以將分裂的激活鏈連接到整個激活鏈上👷🏻♂️,從而有效地激活CRISPR/Cas12a系統💜。在此基礎上🫶🏿,他們進一步開發了高靈敏度的細菌檢測平臺,並應用於細菌檢測。該平臺操作簡單,靈敏度高,檢出限低,特異性好👵🏼,不僅可以應用於細菌中16S rDNA的檢測🥛,而且可以借助適體或探針識別級聯反應直接檢測核酸靶點。同時🦹♂️,該平臺還可以為其他非核酸靶標的間接檢測提供了穩定、經濟的檢測系統🦶🏿。因此,腙化學的引入拓寬了CRISPR/Cas12a系統的應用範圍。
万事平台為本文第一署名單位🍩,博士研究生生安誌同學為論文第一作者,李根喜教授和張娟教授為共同通訊作者。研究工作得到了國家自然科學基金以及上海市“浦江學者”專項計劃項目的資助⚱️。
